El ARN puede inactivar cromosomas

¿Puede el ARN alterar la expresión de los cromosomas? ¿Tienen las mujeres más expresión génica que los hombres? Y lo más importante, ¿qué tiene que ver todo esto con los gatos? Averígualo en este artículo sobre la lionización.
Para responder a todas estas preguntas, nos centraremos en el papel que tiene el último mecanismo introducido por Carlos Romá Mateo en su libro, el ARN no codificante, en la regulación epigenética a través de uno de los ejemplos que el propio Romá menciona: la inactivación del cromosoma X en las hembras de los mamíferos.
¿Qué es la lionización?
Como ya sabemos, el ser humano cuenta con 22 pares de cromosomas autosómicos y un par de cromosomas sexuales, XX en mujeres y XY en hombres. Estos cromosomas sexuales se originaron a partir de un par de autosomas que sufrieron una evolución asimétrica a lo largo de millones de años. Esta diferencia en la evolución de ambos cromosomas sexuales es evidente: el cromosoma Y ha degenerado y perdido la mayor parte de su contenido genético. Esto conduce a un problema: si las mujeres tienen 2 cromosomas X, tendrán el doble de expresión génica de este cromosoma que los hombres, lo que es relevante pues este cromosoma cuenta con información genética muy importante no asociada al desarrollo sexual. La evolución nos ha permitido poner fin a este problema gracias a la inactivación del cromosoma X, también conocida como lionización. Este proceso es fundamentalmente epigenético, pues está bajo la regulación de un ARN no codificante largo (lncRNA), Xist; e implica el silenciamiento heredable de todo un cromosoma sin necesidad de cambios en la secuencia de nucleótidos del ADN. En esta entrada, veremos de manera general algunos de los mecanismos más importantes de esta inactivación.
Añadir que todavía se desconocen muchos de los fenómenos exactos que dominan
este proceso, y que además la mayor parte del conocimiento que se tiene procede
de estudios con ratones, de manera que lo que se va a exponer hace referencia
únicamente a estos animales y puede ser distinto en humanos
Elección del cromosoma a desactivar
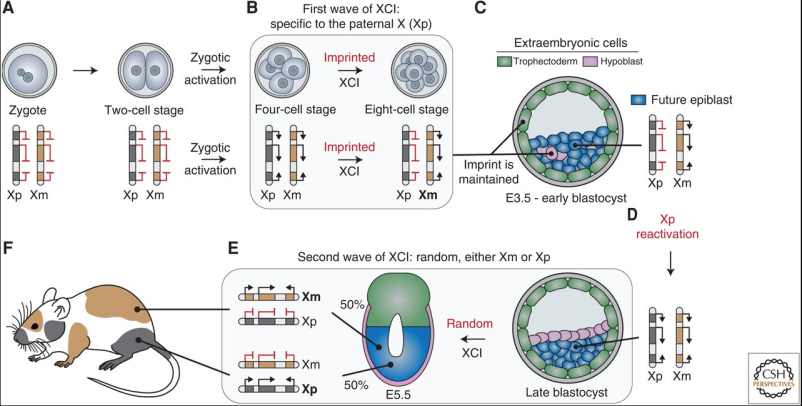
El proceso de lionización comienza en las etapas más tempranas de desarrollo embrionario, puesto que todas las células del blastocisto tienen un cromosoma X inactivado. En este momento, el cromosoma X inactivado es siempre el de origen paterno, por eso esta inactivación se dice que está improntada. Mientras que las células que darán lugar a las estructuras extraembrionarias mantienen este silenciamiento, las células de la masa celular interna, que posteriormente darán lugar al embrión, experimentan una reactivación del cromosoma X. Esta reactivación no es duradera, pues una vez ya se ha formado el epiblasto se vuelve a silenciar, pero en esta ocasión la elección se hace al azar. Es por esta razón que los tejidos adultos femeninos tendrán una expresión en mosaico de los genes del cromosoma X. Ejemplo claro de esto, respondiendo a una de las preguntas iniciales, es el de los gatos carey, cuyos genes de la coloración del pelo residen en el cromosoma X.
El responsable de esta inactivación
Tras años de investigación, se descubrió un locus génico en el cromosoma X que parecía ser responsable de la lionización, el locus XIC (X-inactivation center). Más adelante, se observó en este locus la existencia de un gen que tan solo se expresa en el cromosoma X inactivo, el gen Xist. Este gen, que como ya hemos mencionado codifica para un lncRNA, no sale del núcleo, puesto que se acumula y "reviste" el cromosoma que lo expresa, es decir, el inactivo. La precisa regulación de la expresión de Xist en las células madre embrionarias se da fundamentalmente a nivel de la transcripción mediante una compleja red de factores de transcripción.
El gen Xist, localizado en el locus XIC, es el principal responsable de la inactivación del cromosma X.
Uno de los factores más importantes que regulan la expresión de Xist es Tsix, cuyo ingenioso nombre resulta de darle la vuelta a Xist, de la misma manera que Tsix se transcribe del mismo locus de Xist solo que en sentido contrario (transcripción antisentido). Este gen (que por tanto es otro ARN no codificante largo) inhibe la expresión de Xist, de manera que antes de la inactivación la mayor transcripción de Tsix impide la expresión de Xist. Otros factores importantes son Jpx y Ftx, que también están localizados en el locus XIC y permiten la activación de Xist mediante mecanismos aún por comprender.
En ciencia, toda regla tiene excepciones
Si bien los efectos de la inactivación alcanzan a prácticamente todo el cromosoma, la secuencia y la forma en que esto ocurre es muy diversa, con genes que se inactivan ya desde etapas muy tempranas del desarrollo, otros que no lo hacen hasta que han transcurrido días e incluso algunos que escapan del silenciamiento y se siguen expresando en el cromosoma X inactivo de células somáticas. Además, estos genes libres de inactivación varían sobremanera entre tejidos del mismo individuo, entre individuos y entre especies. Diversos estudios apuntan a que estos genes "liberados" podrían tener importancia en algunas características propias femeninas (y por ello su expresión doble con respecto al macho es necesaria) o que algunos de ellos son los genes que se expresan en la región pseudoautosómica del cromosoma X, y por tanto también están doblemente expresados en el macho.
Mecanismos epigenéticos regulados por Xist
En cuanto a los mecanismos que media Xist, podemos afirmar que este, al revestir el cromosoma, crea un compartimento en él. Dentro de este compartimento, compuesto inicialmente por segmentos de ADN repetitivos, se situarán los genes que quedan silenciados, mientras que fuera encontramos los que escapan al silenciamiento. Se ha descubierto que dentro del compartimento las concentraciones de la ARN polimerasa II son eminentemente inferiores a las que nos encontramos en el nucleoplasma. No obstante, aún queda por revelar si la localización de los genes en el compartimento es causa o consecuencia de su silenciamiento. También se sabe que Xist media modificaciones en las histonas del cromosoma, entre las que encontramos su desacetilación y ubiquitinación.
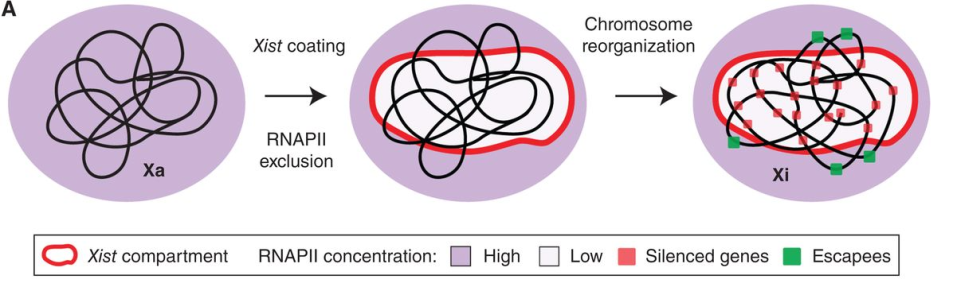
Cabe destacar que, al contrario de lo que muchos investigadores intuían, Xist no recluta directamente silenciadores de la actividad de la cromatina, sino que recluta proteínas scaffold que posteriormente son las responsables de iniciar cascadas de silenciamiento de la cromatina. Entre estos mecanismos encontramos complejos metiltransferasa (destaca WTAP) que, además de al ADN, también pueden metilar Xist; y el reclutamiento del complejo Polycomb (importante complejo de silenciamiento epigenético). Otro mecanismo fundamental del silenciamiento ejercido por Xist es la proteína SPEN, que media silenciamiento génico mediante mecanismos que todavía están siendo estudiados.
El mantenimiento de la inactivación a lo largo de las divisiones celulares también es sujeto de investigación, y la realidad es que en este momento es un tema muy complejo, con muchos focos de conflicto como la necesidad de metilación en las estructuras embrionarias pero no en las extra-embrionarias; que la pérdida de expresión de Xist no altera el mantenimiento de la inactivación en algunos linajes celulares pero sí en otros; que esta pérdida de expresión puede afectar más en caso de que la célula esté sujeta a estímulos de estrés; la distorsión de la expresión de Xist en células tumorales…
El corpúsculo de Barr
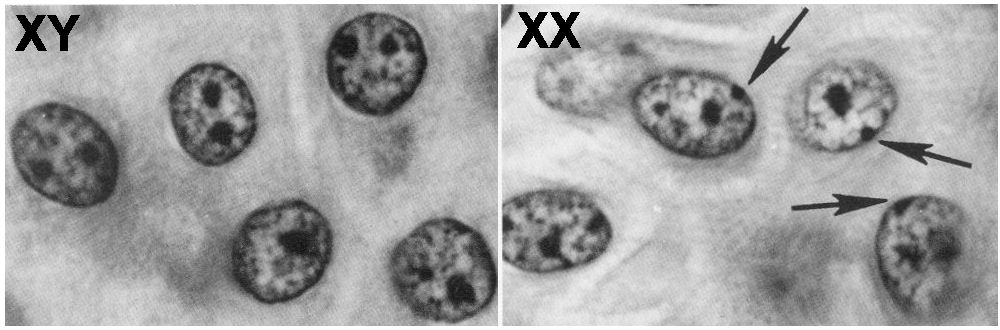
Destacar la localización intranuclear del cromosoma X inactivo, visible a microscopía como el denominado corpúsculo de Barr. Este cromosoma se suele encontrar asociado a la membrana en la periferia del núcleo. El descubrimiento del emparejamiento transitorio de ambos cromosomas en las etapas iniciales de la inactivación llevó a la hipótesis de que este contacto permitía a los cromosomas percibirse el uno al otro y elegir cuál inactivar; si bien esta hipótesis fue rechazada por estudios posteriores.
El poder de la epigenética
Como hemos visto, el fenómeno de inactivación del cromosoma X es uno de los mayores exponentes del efecto que la epigenética tiene en nuestro organismo, así como de la compleja regulación y mecanismos que presenta el silenciamiento de genes mediado por los ARN no codificantes. Es especialmente relevante que mecanismos epigenéticos por sí mismos sean capaces de alterar de manera tan drástica la expresión de dos cromosomas homólogos que comparten un mismo espacio en el núcleo. Esto no debe sino animarnos a seguir investigando el papel de la epigenética en más procesos fisiológicos fundamentales.
Bibliografía
(1) Dossin, F., & Heard, E. (2022). The Molecular and Nuclear Dynamics of X-Chromosome Inactivation. Cold Spring Harbor perspectives in biology, 14(4), a040196. https://doi.org/10.1101/cshperspect.a040196
(2) Pinheiro, I., & Heard, E. (2017). X chromosome inactivation: new players in the initiation of gene silencing. F1000Research, 6, F1000 Faculty Rev-344. https://doi.org/10.12688/f1000research.10707.1
